惡性腦癌之一膠質母細胞瘤,近年來有甚麼治療對策
- Muting Functional Medicine

- 2023年4月25日
- 讀畢需時 13 分鐘
已更新:2025年11月24日

摘要: 膠質母細胞瘤(GBM)是最惡性的原發性腦瘤,生長迅速、侵襲性高,五年存活率僅約 7.2%。傳統治療以手術、放射線與化療為主,但因腫瘤難以完全切除且具有治療抗性,預後仍差。近年新興對策包括基因治療、靶向 EGFRvIII/IDH1 等突變、免疫療法(如 PD-1 抑制劑、CAR-T)、幹細胞策略等,但仍多處在臨床試驗階段。
2019 年在《Stem Cell Research & Therapy》發表的研究顯示,氫分子吸入可促使膠質瘤幹細胞分化、抑制腫瘤生長與侵襲、減少血管新生,並延長實驗動物存活率,提出非傳統的新潛力方向。然而氫分子仍屬前期研究,真正應用於 GBM 治療前仍需更多臨床驗證。
現階段面對膠質母細胞瘤,標準醫療仍須以手術+放療+化療為主軸,而新型療法(含氫分子)只能視為可能的未來發展方向,且需在專業醫師監督下進行治療決策。
膠質母細胞瘤治療方式
膠質母細胞瘤常規治療方式通常包括手術切除、放射線治療和化學治療。這些治療方式的目的是盡可能地切除腫瘤、殺死腫瘤細胞,並延長病人的生存時間。但由於膠質母細胞瘤的高度惡性和治療抵抗性,它的預後非常不良。近年來,隨著醫療技術的進步和新的治療方法的發展,膠質母細胞瘤的治療效果正在不斷提高。運用免疫療法、靶向治療等新技術,可以提高膠質母細胞瘤的治療效果和生存率。
臨床上手術切除是治療膠質母細胞瘤的第一步,通過手術可以切除大部分或全部的腫瘤,減少腫瘤對腦部的損害。腦部手術風險較高,無法切除全部的腫瘤,需要進一步的放射線治療和化學治療。放射線治療是通過高能量的輻射線殺死腫瘤細胞的治療方式,可以減少腫瘤的體積和控制腫瘤的生長。化學治療是使用化學藥物殺死腫瘤細胞的治療方式,可以通過靜脈注射或口服給藥進行。
儘管 GBM 對治療普遍具有抗性,預後仍然不佳,但近年因 免疫療法、基因靶向治療、腫瘤疫苗與個人化醫學 的快速進展,使治療策略逐漸從「控制疾病」走向「延長存活、改善生活品質」。未來的多模組治療,將可能成為提升 GBM 預後的關鍵。
膠質母細胞瘤醫療的機遇及挑戰
膠質母細胞瘤(GBM)的現行治療仍以 手術、放療、化療 為主軸,但腫瘤高度浸潤性、異質性強、具免疫抑制微環境等特性,使治療成效長期受到限制。這也是為何 GBM 的復發率高、預後依然不理想。近十年來,科學家開始從 腫瘤基因、免疫調節、腫瘤幹細胞(GSCs) 等方向切入,帶來新的研究契機:
1. 基因治療的機會
EGFRvIII、IDH1、PTEN 等突變被視為 GBM 特徵性標記。透過病毒載體、siRNA、CRISPR 等策略,有望直接干預腫瘤細胞的生長訊號。目前仍屬研究與早期臨床階段,障礙在於:
腫瘤異質性高,單一基因標靶難以涵蓋所有細胞
腦部藥物遞送(BBB)是重大瓶頸
2. 腫瘤免疫治療的潛力
CAR-T、PD-1/PD-L1 抑制劑、腫瘤疫苗等方法已成功應用在多種癌症,但在 GBM 的效果不如預期,原因包括:
腦腫瘤微環境具免疫抑制特性
腫瘤突變負荷低,抗原性較弱
BBB 限制免疫細胞進入
不過早期臨床顯示局部注射、腫瘤內遞送以及結合併療可能改善反應
3. 腫瘤幹細胞作為新突破點
GBM 的復發主要來自 腫瘤幹細胞(GSCs),它們:
對放療與化療高度耐受
能自我更新並重建腫瘤因此「讓 GSCs 失去幹性並轉向分化」被視為重要策略。這也是你文章後半段提到的 氫分子誘導 GSCs 分化(Stem Cell Res Ther, 2019)成為值得關注的研究方向。
4. 挑戰仍大、臨床尚需整合策略
即便新技術快速發展,GBM 的治療仍面臨:
極高的腫瘤異質性
腦部微環境的免疫抑制
BBB 屏障造成的藥物遞送阻力
幾乎所有治療最後都面臨復發
現階段的關鍵仍是傳統治療為主體,新療法作為輔助或臨床試驗選項,建立「多模組整合治療」才有機會改善預後。
面對膠質母細胞瘤還有甚麼對策?
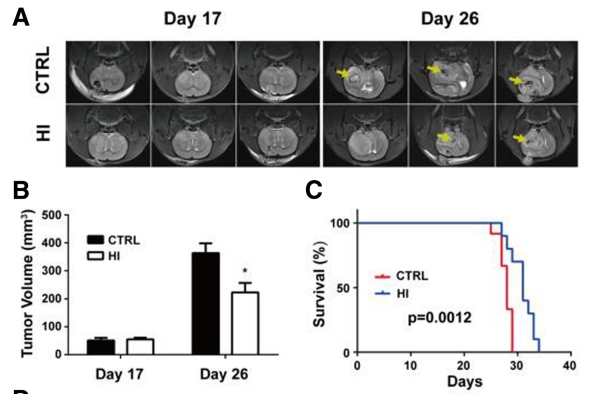
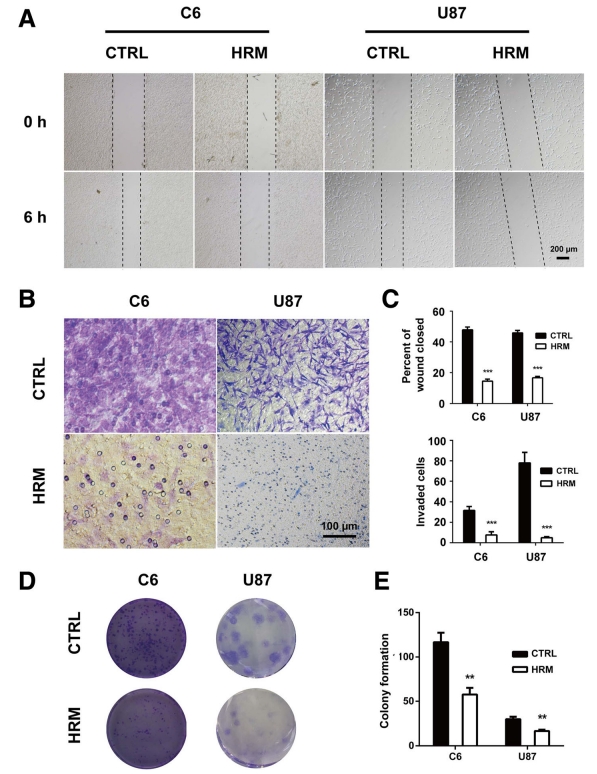
於2019年9月《Molecular Cancer Therapeutics》期刊中發表了一篇"Molecular hydrogen suppresses glioblastoma growth via inducing the glioma stem-like cell differentiation"氫分子通過誘導膠質瘤幹細胞樣細胞分化抑製膠質母細胞瘤生長,這一篇論文提到氫分子對膠質母細胞瘤生長的影響及其作用機制。
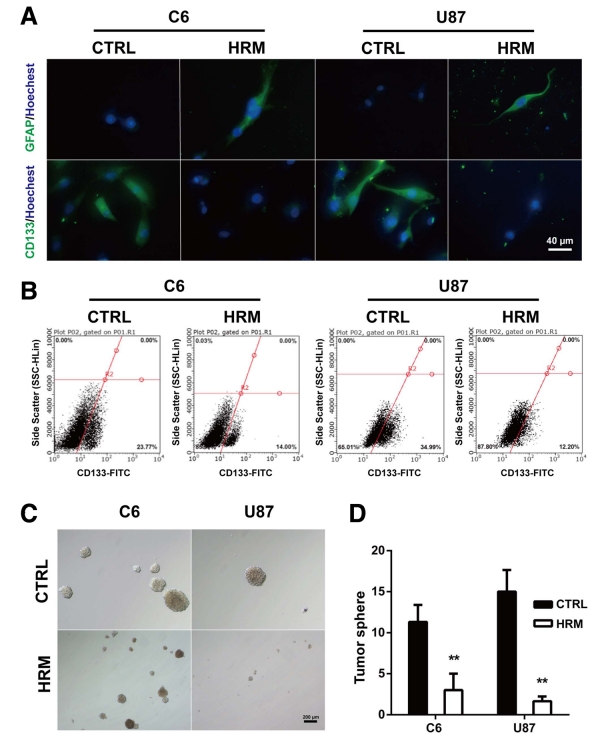
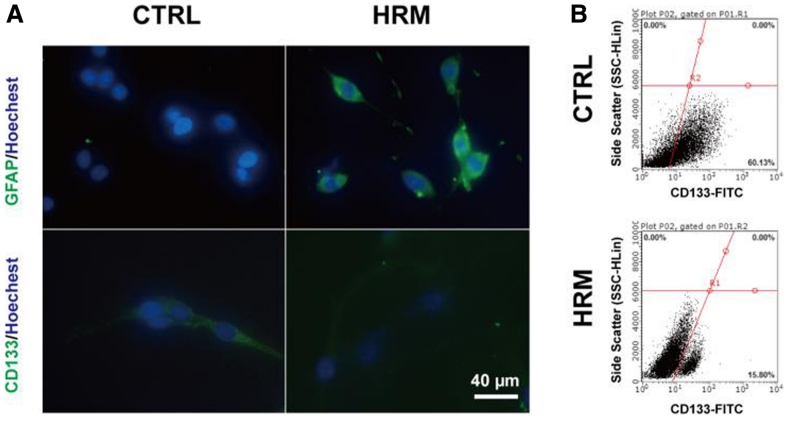
在論文中,研究人員發現吸入氫氣「氫分子」可以抑制膠質母細胞瘤細胞的生長,進一步研究表明,這種抑制作用是通過誘導膠質母細胞瘤幹細胞向成熟細胞分化的方式實現的。
幹細胞是一種可以自我更新並具有分化能力的細胞,具有很高的腫瘤形成能力。在膠質母細胞瘤中,膠質母細胞瘤幹細胞被認為是導致腫瘤復發和治療失敗的主要原因之一。因此,誘導幹細胞向成熟細胞分化可能是一種治療膠質母細胞瘤的新策略。
氫分子是一種具有強抗氧化和抗炎作用的氣體,已被證明對多種疾病具有治療潛力。本研究發現,氫分子可以通過抑制膠質母細胞瘤幹細胞的增殖和誘導其向成熟細胞分化,抑制膠質母細胞瘤的生長和轉移。
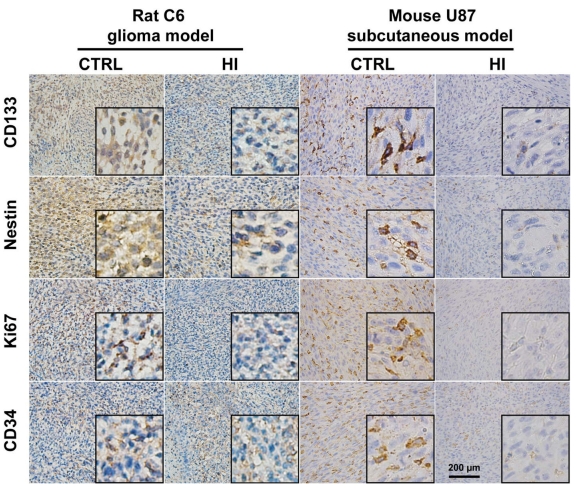
統計結果表明,氫氣治療組的腫瘤體積明顯較小並顯著延長生存時間,氫氣通過抑制血管新生來降低腫瘤生長,且抑制腦癌細胞的增殖和侵襲,並且干預了GFAP和CD133的表達以及腦癌幹細胞的自我更新能力。氫氣降低C6膠質瘤細胞中CD133表達的細胞數量。結果表明氫氣能夠促進膠質瘤細胞的分化,降低幹細胞特性的表達,並增加神經元特性的表達。研究顯示了在氫氣處理後,癌細胞的移動能力逐漸減弱,細胞的侵襲能力明顯下降。
上面說明來自於以下實驗研究的統計分析及切片圖
研究作者結論:氫氣吸入抑製膠質母細胞瘤生長
該論文的結果表明,氫分子可能是一種治療膠質母細胞瘤的潛在治療方法,可以通過誘導幹細胞向成熟細胞分化,抑制膠質母細胞瘤的生長和轉移。然而,該研究仍需進一步的實驗和臨床試驗來確定其在膠質母細胞瘤治療中的療效和安全性。
有任何的癌症相關疾病,需遵從醫生建議,並且需要使用常規的治療為第一優先手段,上述的新興療法尚需擴大臨床驗證其安全性及有效性。請遵從醫囑積極治療找回健康。

延伸閱讀:
2024 年發表於《Frontiers in Neurology》的臨床隨機對照試驗,首次在人類病房環境中證實氫氣吸入能安全、有效地減輕腦水腫並改善術後恢復,為氫分子醫學開啟臨床應用的新篇章。氫氣吸入降低膠質瘤術後腦水腫:隨機臨床研究揭示非侵入性治療新契機
膠質母細胞瘤(GBM)常見問答 FAQ
膠質母細胞瘤是什麼?是不是腦癌?
是。膠質母細胞瘤(GBM)是一種高度惡性的原發性腦腫瘤。它長得快、會往附近腦組織浸潤,很難「全部挖乾淨」。這不是轉移癌,它是腦本身長出來的癌。
為什麼這麼難治?
幾個主因:
GBM 細胞像藤蔓一樣往外爬,常常已經滲到正常腦組織裡,所以就算拿掉主腫塊,殘存細胞還在。
腦不是肝臟,不能「多切一塊」隨便補回來。太激進會造成失語、癱瘓、昏迷。
GBM 內部細胞異質性很高(同一顆腫瘤裡面就像一個雜牌軍聯盟),導致它很快對藥物產生抗藥性。
腦有血腦屏障,很多藥物進不去。
總結:不是醫生不夠專業,是腫瘤的生物學本身就很邪門。
平均可以活多久?
典型數字:大約 12~18 個月。五年後仍存活的人,大約個位數百分比。這是整體統計,不代表個案命運已經被寫死。有人活不到一年,也有人撐多年,差異跟年齡、腫瘤位置、腫瘤基因型、治療完整度、病人身體功能都有關。
標準治療流程是什麼?
順序通常是:
手術:盡量把腫瘤切到「安全範圍內的最大量」。
放射線治療 + 化學治療:同步進行數週。
維持期替莫唑胺:放療後繼續口服 TMZ 幾個月的循環。
腫瘤電場治療:頭皮貼電極、天天戴機器,藉由電場干擾癌細胞分裂,已被證實可以延長存活期。
→ 以上不是「研究用」,而是目前國際上認為的標準路線。
手術可以切乾淨嗎?可以「根治」嗎?
通常不能保證。GBM 不是長成一顆圓球乖乖坐著,它會滲進腦組織。所以開刀重點是「最大安全切除」:盡量拿掉肉眼/影像看得到的腫塊,同時不要讓病人變成植物人。這手術本身就已經是很高難度的平衡。
什麼是「腫瘤電場治療」?很玄嗎?
不玄,它其實是目前少數「真的在人類三期試驗證明能延長壽命」的新工具。
原理:在頭皮貼上電極貼片,機器產生交變電場干擾腫瘤細胞分裂,讓癌細胞比較難複製自己。特點:
不用吃藥,不是化療,不是放療。
重點副作用是頭皮皮膚刺激/起水泡,系統性副作用少。
缺點是超麻煩:要幾乎整天戴著,頭髮要剃,外觀明顯,攜帶電池。依從度差,效果就差。
很多國家已經把它列為新診斷 GBM 的標準加成治療之一。不是偏方,是有數據的東西。
病人一定適用腫瘤電場治療嗎?
不是每個人都適合。
病人要有足夠體力願意長期配戴。
要接受外觀改變(幾乎得剃頭)。
有些地區/保險系統不給付,費用可能很高。→ 但如果能夠戴,醫學證據顯示平均生存期可以比只用化療更長。
有沒有免疫療法?檢查點抑制劑有用嗎?
直白說:不像肺癌或黑色素瘤那樣神奇。
免疫檢查點抑制劑(例如 PD-1 抑制劑)單獨用在新診斷或復發的 GBM,大型臨床試驗多半沒有顯示明確延長整體存活期。原因:GBM 是所謂「免疫冷腫瘤」,免疫細胞很難進去,也不太認得它。
現在正在研究的是「組合療法」:把免疫療法跟放療、電場治療、或局部病毒治療一起用,嘗試把腫瘤變成免疫系統看得見的目標。這還在臨床試驗階段,還沒是日常標準。
翻成白話:免疫療法不是沒希望,但目前還不是「保證有效、健保給付」的等級。
CAR-T 細胞療法可以治好嗎?
CAR-T = 把病人的 T 細胞改造成「會特別咬某個腫瘤標記」的殺手,然後打回去。
在少數復發 GBM 病人身上,CAR-T 造成腫瘤明顯縮小,甚至一度看不到。這是真的有發生過。但,兩個巨大問題:
腫瘤會「換臉」:原本的標記不見了,腫瘤又長回來。
CAR-T 在腦裡也可能引發腦水腫、神經毒性,很危險。
目前 CAR-T 對 GBM 還屬於臨床試驗,通常要滿足特定條件(腫瘤要表達特定抗原、可接受腦室內注射等等)。不是一般醫院可以隨手安排,也不是保證救命。
聽說有「樹突細胞疫苗」?那個是不是比較有希望?
這個是目前最值得嚴肅關注的免疫療法之一。
做法:把手術切下來的腫瘤碎片拿去跟病人自己的樹突細胞(免疫細胞的一種)一起培養,做成「客製化腫瘤疫苗」,再打回病人體內,教免疫系統認得腫瘤。
在一個大型的前瞻性試驗裡(加上外部對照做比較),這種疫苗加上標準治療的病人,平均整體存活期比歷史/對照組長,而且副作用整體可接受。這是少數在人類身上「看到整體存活期往上拉」的免疫療法訊號。
壞消息:監管單位還在審(各國規則不一),取得方式常常還是臨床試驗或特定計畫,不一定「走進任一醫院就能打」。
翻成家屬語言:這不是江湖偏方,是真的有科學數據,但目前在法規和可近性上還沒全面普及。
有沒有「吃藥就好,不用放療化療」的新藥?
如果是典型的「膠質母細胞瘤,IDH-wildtype」,目前沒有口服小藥丸就能取代手術+放療+化療的證據。
有例外族群:某些比較慢的膠質瘤現在開始有腦滲透型 IDH 抑制劑證明可以延長「腫瘤惡化前的時間」。但注意:那群腫瘤跟典型 GBM 在生物學上不是同一隻怪獸。這不能直接套用到大多數膠質母細胞瘤患者身上。
「氫氣吸入治療」/「氫分子」是真的嗎?朋友說吸氫氣可以讓腦瘤分化。
現階段:還沒證明在人類臨床能延長膠質母細胞瘤患者壽命。
重點要講清楚:
在動物(大鼠)和細胞實驗裡,吸氫氣確實看到:腫瘤長得慢、腫瘤幹細胞特徵下降、老鼠活比較久。
但是,我們還沒有大型、嚴謹、隨機對照的人類臨床試驗證明:長期吸氫 = 活得更久、生活品質更好、沒有嚴重副作用。
換句話說,它是「新的研究方向」,但還不是臨床標準。如果有人跟你說「氫氣可以治癒腦癌,不用化療放療」,請非常小心 —這句話目前沒有臨床證據支持,而且延誤標準治療會讓病人損失黃金時間。
我們應該去參加臨床試驗嗎?
如果病人條件允許,答案往往是:值得認真評估。
原因:
復發 GBM 幾乎沒有「保證有效的第二線標準藥」。
很多下一代療法目前只在臨床試驗裡拿得到。
臨床試驗也意味著嚴密監測(更多 MRI、更多神經功能評估),不一定比較危險,反而可能更被盯得緊。
現實考量:地點、經濟、病人的體力與神志狀態,決定能不能實際參與。
我們該怎麼判斷醫療團隊是不是「有在跟上進展」?
可以問問題,醫師應該可以回答,且不會生氣:
「病理報告和基因分析有出來嗎?」
「在這家醫院或附近中心,復發時有沒有臨床試驗能收案?」
如果醫療團隊願意清楚說明現實限制而不是畫大餅,這反而是好徵兆。
除了延長壽命,我們能做什麼提高生活品質?
這點經常被忽略,但對病人和家屬的壓力其實最大:
癲癇控制(抗癲癇藥物)
顱內壓/水腫控制(類固醇、滲透壓治療等,需醫師監控副作用)
復健(語言治療、物理治療、職能治療)
情緒/睡眠/認知支持(不是放棄,是幫助清醒、有尊嚴地活)
法律/照護規畫(預立醫療決定、誰是照護代理人等)──提早談,比臨時手忙腳亂好。
一句很現實的話:GBM 沒有「等治好再來談生活品質」這個奢侈條件。支持療法要跟腫瘤治療同時開始。
我們應該害怕問壞消息嗎?
不需要。問清楚其實是在爭取時間跟主導權。醫療團隊如果能老實講真相,同時提供「下一步的實際選項」而不是只給希望語錄,那通常代表他們是真的在為病人盤算,而不是只在安撫家屬情緒。
我們現在應該在意的是什麼?
三個優先順序,按重要性排:
病人現在「還能做什麼」,而不是「理論上腫瘤細胞在小鼠怎樣」。
病人「還想怎麼活」,而不是單純延長呼吸日數。
哪些治療有實際數據,而不是 網路上的神藥。
把資源(時間、體力、金錢)投在這三件事上。
名詞及註解:
聯合新聞網:全台首例 CAR-T療法治癒血癌女孩 台大醫院患者接受了CAR-T細胞療法的治療,經過治療後,病情明顯好轉甚至痊癒。CAR-T細胞療法是一種非常有前途的治療方式,可以將患者的T細胞進行基因改造,讓其能夠辨識並攻擊癌細胞。該療法仍在不斷發展和完善中,未來可能對多種癌症的治療產生重要影響。
EGFRvIII是一種突變形式的表皮生長因子受體(EGFR),常見於某些腫瘤細胞,特別是在胶质母细胞瘤中。EGFRvIII突變可以促進腫瘤細胞增殖和存活,並與腫瘤的侵袭性和惡性程度有關。
PTEN是一種腫瘤抑制基因,其作用是抑制磷脂酰肌醇3-激酶(PI3K)信號通路,這個通路與許多腫瘤的發生和發展有關。PTEN基因的缺失或突變可能會導致PI3K信號通路的過度活化,進而促進腫瘤的生長和轉移。
IDH1是一種同工酶,參與細胞的代謝過程。IDH1基因的突變與某些腫瘤的發生和發展有關,特別是在低級別的胶质母细胞瘤中。IDH1突變可能會影響細胞代謝,促進腫瘤細胞增殖和存活,並對腫瘤治療的反應產生影響。
CAR-T細胞療法是一種基因治療技術,是利用體外培育的懸浮細胞來攜帶一種特殊的受體,即融合型抗原受體(CAR),將其注入患者體內,以調節患者的免疫系統來打擊癌細胞。
PD-1(programmed cell death protein 1)和PD-L1(programmed cell death ligand 1)是人體免疫系統中的蛋白質分子,它們在調節免疫反應方面扮演著重要的角色。
GFAP(glial fibrillary acidic protein)是一種膠質纖維酸性蛋白質,在膠質細胞中廣泛表達,特別是在星形膠質細胞中。GFAP在神經細胞與膠質細胞之間發揮著重要的結構支持作用,也可以作為膠質細胞增殖和分化的標記物。
CD133(cluster of differentiation 133)是一種表達在細胞表面的膜蛋白,它被認為是神經幹細胞的標記物,因為它在這些細胞中表達量較高。CD133+細胞具有較高的增殖和分化能力,並被認為是腦瘤中的幹細胞,這些細胞被認為對治療抵抗性和腫瘤復發負責。
C6細胞是一種在實驗室中廣泛使用的大鼠膠質母細胞瘤細胞系,這種細胞可以通過在實驗室中培養進行研究。C6細胞具有快速生長和高度侵略性的特點,是研究膠質母細胞瘤的常用模型之一。
參考文獻:
Xie, K., Yu, Y., Huang, Y., Zheng, L., Li, J., Chen, H., Han, H., Hou, L., Gong, G., & Wang, G. (2012). Molecular hydrogen ameliorates lipopolysaccharide-induced acute lung injury in mice through reducing inflammation and apoptosis. Shock, 37(5), 548-555. https://doi.org/10.1097/SHK.0b013e31824ddc81 (Xie K 等人. 「分子氫通過減少炎症與凋亡改善小鼠脂多醣誘導的急性肺損傷」。《Shock》,2012;37(5):548-555。)
Ishibashi, T., Sato, B., Rikitake, M., Hara, Y., Yamamoto, T., Nakamura, M., … & Hori, Y. (2014). Therapeutic efficacy of infused molecular hydrogen in saline on rheumatoid arthritis: A randomized, double-blind, placebo-controlled pilot study. International Immunopharmacology, 21(2), 468-473. https://doi.org/10.1016/j.intimp.2014.06.001 (石橋 T 等人. 「靜脈輸注富氫生理鹽水對類風濕性關節炎的治療療效:隨機、雙盲、安慰劑對照試驗。」《International Immunopharmacology》,2014;21(2):468-473。)
Brown, C. E., Alizadeh, D., Starr, R., Weng, L., Wagner, J. R., Naranjo, A., … & Yang, X. (2016). Regression of glioblastoma after chimeric antigen receptor T-cell therapy. New England Journal of Medicine, 375(26), 2561-2569. https://doi.org/10.1056/NEJMoa1610497 (Brown C.E. 等人. 「嵌合抗原受體 T 細胞療法後膠質母細胞瘤退縮。」《新英格蘭醫學雜誌》,2016;375(26):2561-2569。)
O’Rourke, D. M., Nasrallah, M. P., Desai, A., (… 等). (2017). A single dose of peripherally infused EGFRvIII-directed CAR T cells mediates antigen loss and induces adaptive resistance in patients with recurrent glioblastoma. Science Translational Medicine, 9(399), eaaa0984. https://doi.org/10.1126/scitranslmed.aaa0984 (O’Rourke D.M. 等人. 「單劑外周輸注 EGFRvIII 導向 CAR T 細胞導致抗原喪失並誘發復發性膠質母細胞瘤患者的適應性抗拒。」《Science Translational Medicine》,2017;9(399):eaaa0984。)
Ahmed, N., Brawley, V., Hegde, M., Bielamowicz, K., Kalra, M., Landi, D., … & Gottschalk, S. (2017). HER2-specific chimeric antigen receptor–modified virus-specific T cells for progressive glioblastoma: A phase 1 dose-escalation trial. JAMA Oncology, 3(8), 1094-1101. https://doi.org/10.1001/jamaoncol.2017.0184 (Ahmed N 等人. 「針對進展性膠質母細胞瘤之 HER2-特異性嵌合抗原受體–病毒特異性 T 細胞:第 1 期劑量遞增試驗。」《JAMA Oncology》,2017;3(8):1094-1101。)
Pellegatta, S., Savoldo, B., Di Ianni, N., Corbetta, C., Chen, Y., Patané, M., … & Dotti, G. (2018). Constitutive and TNFα-inducible expression of chondroitin sulfate proteoglycan 4 in glioblastoma and neurospheres: Implications for CAR-T cell therapy. Science Translational Medicine, 10(435), eaao2731. https://doi.org/10.1126/scitranslmed.aao2731 (Pellegatta S 等人. 「膠質母細胞瘤及神經球體中軟骨素硫酸蛋白聚糖 4 的固有與 TNFα 誘導表達:對 CAR-T 細胞療法的啟示。」《Science Translational Medicine》,2018;10(435):eaao2731。)